「CRCから見た監査対応について教えてください」の質問と回答のページです。質問に対しての回答投稿が可能です。マナーを守って有意義に利用しましょう。(削除申請はこちらからお願いします)
CRCから見た監査対応について教えてください
 質問
質問

CRCから見た監査対応について教えてください
2年目看護師です。CRCの監査対応について教えてください。
現在、病院で2年目の看護師として働いています。将来的にCRC(治験コーディネーター)への転職を考えているのですが、先日、院内でCRCさんが治験の監査対応をされている場面を見かけました。
監査の方がいらっしゃって、書類を隅々まで確認されている様子で、CRCさんがすごくプレッシャーを感じていらっしゃるように見えました。その光景を見て、「監査ってどれくらい大変なんだろう?」と不安に感じています。
CRCをされている方、または監査の経験がある方に、監査対応についてぜひ教えていただきたいです。
監査では、どれくらいの期間をかけて、どれくらいの資料を準備するのでしょうか?
本当に書類をルーペで1枚ずつ確認するような、細かいチェックが行われるのでしょうか?
「こんな細かいところまで見られた」「こんな指摘をされて冷や汗をかいた」といった具体的な体験談があれば、ぜひ聞かせてください。
大変な仕事だとは思いますが、やりがいも感じてみたいと思っています。どうぞよろしくお願いいたします。 2025年9月21日
2025年9月21日  510
510
 マンガで分かる!看護師から治験コーディネーター(CRC)へ転職
マンガで分かる!看護師から治験コーディネーター(CRC)へ転職
 AIによる要約
AIによる要約
 マンガでわかる
マンガでわかる

 イラスト・図解でわかる
イラスト・図解でわかる
 みんなの回答一覧
みんなの回答一覧
- 監査対応はチームで臨む ベストアンサー
-
CRC5年目です。
私は直接監査の窓口を担当したことはありませんが、先輩と一緒に準備から当日の対応に立ち会った経験があります。監査が実施される理由はいくつかあります。ポジティブな監査としては、FPI(試験全体で最も早く症例を組み入れた施設)や、試験全体で最も多く症例を組み入れた施設が対象になる場合があります。一方、ネガティブな監査としては、逸脱が多い施設や重大な逸脱(GCP違反など)が発生した施設が対象となる可能性が高いと聞いています。
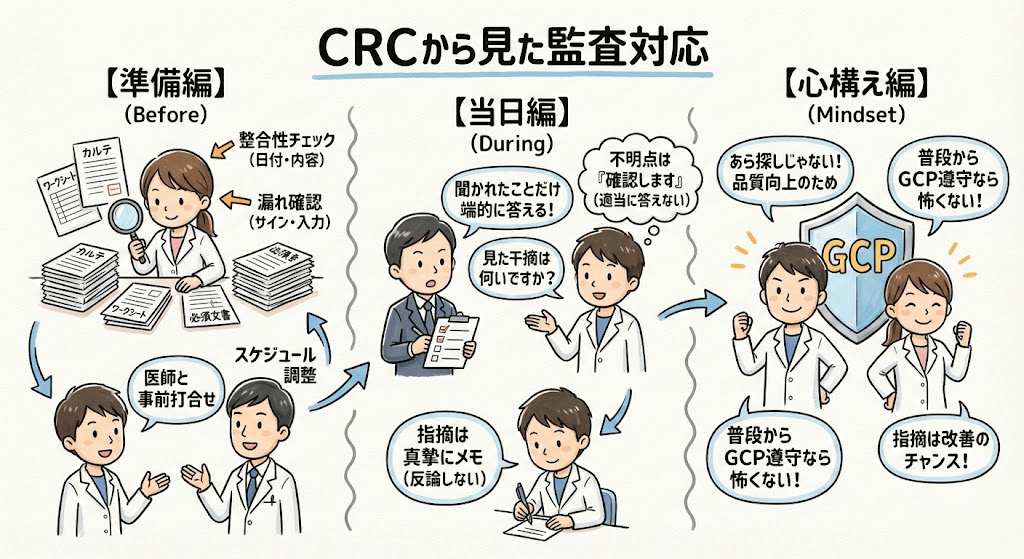
■監査の準備
およそ1~2か月前に担当CRAから「監査を行います」という連絡があり、まずは社内で情報を共有します。私はSMOのCRCなので、社内に品質管理部門があり、監査前に事前チェックを依頼できます。品質管理部門では、症例ファイル、治験薬管理簿・温度記録、治験関連文書が規定されたプロセスに沿って作成・運用されているかを確認し、メインCRCへのヒアリングを通じて不備がないかを洗い出します。その上で、監査当日までに修正すべき事項や、当日の対応方法についてフィードバックを受けます。
■監査当日の対応
当日は監査担当者と名刺を交換し、別室で治験関連部署の監査が始まります。途中でPI(治験責任医師)や治験薬管理者との面会があり、監査担当者からの疑義事項に回答いただきます。そのため、事前に関係者と入念な打ち合わせをしておくことが大切です。CRC自身は、監査の合間は通常業務を行い、監査終了後にフィードバックを受けます。疑義事項や修正が必要な点はその場で対応し、後日、正式な監査報告書が送付されます。
■監査を通じて感じること
監査といっても、普段からALCOAに基づいたプロセスで治験文書を作成し、定期的に行われるSDVで指摘された事項を確実に対応していれば、大きな問題になることはあまりありません。監査で「良好に管理されていますね」と評価されると、これまでの準備や努力が報われる実感があります。また、指摘を受けたとしても「改善のチャンス」と捉え、次の治験に活かすことができます。何より、「治験データの信頼性を守る」という重要な役割を担っていることを強く感じられる場面でもあります。
監査対応は確かに緊張しますが、事前準備をしっかり行えば乗り越えられますし、チームで対応するため一人で抱え込むものではありません。細かいチェックはされますが、準備を怠らなければ怖がる必要はありません。私は常に、落ち着いて毅然とした態度で臨むことを意識しています。
 2025年9月28日
2025年9月28日
役に立った(3)
- そこまでプレッシャーに感じることはありません
-
CRC3年目です。先月初めて監査を経験しました。
監査に当たることはそうそうないので、私の会社では10年目になる方でも経験したことない方もいらっしゃいます。
まず、監査に対しての準備ですが、社内でまずは上長や社内監査係のような方が書類等を事前にチェックします。私はこれの方が大変でした。2週間ほど期間を設けて準備をして、監査当日を迎えました。
監査担当者はほんと隅々まで確認してますが、「GCPという治験のルール(法律)にのっとった対応が普段からできているのか」「治験の記録の正しい残し方ができているのか」「逸脱(ルールから外れたミスのようなもの)に対して、CRCまたは治験責任医師がどのように対応したのか、その記録はどのように保管されてあるのか」など様々な観点からチェックされます。
監査は堅苦しく怖いイメージがありますが、監査を受けることによって、CRCとしての目線やこれからの業務の質が向上していくと私は思います。
どのようなことに注意すればいいかなど、監査を受けることでとてもいい経験ができました。
 2025年9月27日
2025年9月27日
役に立った(1)
- 以下の記事もご参考にしてください。 公式
-
監査(モニタリング、GCP実地調査)については、以下の記事でも解説しております。
https://crc-bank.com/crcnoshigotonaiyou#d3
(モニタリング・GCP実地調査への対応)
 2025年10月1日
2025年10月1日
- 焦ることは特にありません。
-
今まで3〜4回程度は監査を経験をしたことがあります。
どの監査でも共通していえることは、普段の対応を特に問題なく実施していれば何も恐れることはないといということです。
何か指摘されるようなことが心当たりとしてあるとすれば、事前に準備しておけば問題ありません。
例えば先生が「有害事象として挙げない」と判断した事例があったとします。
この場合、なぜ有害事象として挙げなかったのかを指摘されることは可能性としてはありますが、先生が有害事象と判断しなかった理由を詳細に記録としてあらかじめ残しておけば大丈夫です。
そしてそれは監査のための対応というわけではなく、日頃から何かあれば記録として残しておく必要があります。
SDVでもモニターさんによる原資料の閲覧がありますので、その際の準備も怠ることなく日頃からALCOAを意識しながら業務をしていれば何も問題はありません。
 2025年9月28日
2025年9月28日
役に立った(0)
- 丁寧なチェックというイメージです。
-
監査対応って聞くと少し怖そうなイメージありますよね。
でも、実際は「めちゃくちゃ怖い尋問」というより「ものすごく丁寧なチェック」って感じに近いです。そのため、ルーペで見るようなことは、さすがにありません。
しかし、「日付が間違ってないか」「誰が書いたか」「修正の仕方がGCPに沿ってるか」など、細かいとこは確実に見られます。実際に、治験薬の残数が1錠合わない」事態に遭遇し、現場総出で探したこともありました。
準備に関しては、試験の内容にはよりますが1週間〜3週間程度が妥当かと思います。
 2025年9月27日
2025年9月27日
役に立った(0)
- CRCの監査対応について AI
-
監査はCRCにとって非常に重要な業務の一つであり、大きなプレッシャーがかかる場面であることは事実です。しかし、その分、乗り越えた時の達成感や、治験の品質を支えているという実感を得られる、やりがいの大きい仕事でもあります。
ここでは、CRCの監査対応について、具体的な準備や体験談を交えながら、できるだけ分かりやすくご説明します。
1. 治験の「監査」とは?- 目的と種類を理解しよう
まず、監査が何のために行われるのかを知っておくと、具体的な業務内容も理解しやすくなります。
監査の大きな目的は、「治験がルール通りに正しく行われ、集められたデータが信頼できるものであるか」 を第三者の視点から確認することです。これにより、被験者さんの人権や安全が守られ、お薬の承認申請に使われるデータの信頼性が保証されます。
CRCが対応する監査には、主に2つの種類があります。
◆依頼者監査 (Audit)
◆誰が?: 治験を依頼している製薬会社(または開発業務受託機関CRO)が実施します。
◆目的: 治験がGCP(医薬品の臨床試験の実施の基準に関する省令)や治験実施計画書(プロトコル)を遵守して行われているかを確認します。CRCさんが日常的に関わるCRA(臨床開発モニター)とは別の、独立した部署の担当者が来られます。
◆規制当局による調査 (Inspection)
◆誰が?: 厚生労働省やPMDA(医薬品医療機器総合機構)といった国の機関が実施します。
◆目的: 新薬の承認申請が出された際に、その根拠となった治験データが信頼できるものか、GCPを遵守しているかなどを最終確認します。より公的な調査であり、緊張感も高まります。
2. 監査対応のリアル - 準備から当日まで
監査の期間と準備する資料
監査の通知は、通常、数週間〜1ヶ月以上前に医療機関へ連絡があります。そこからCRCは、医師や治験事務局、薬剤部など、院内の関係者と連携しながら準備を始めます。
準備する資料は、その治験に関わるほぼ全ての書類と言っても過言ではありません。具体的には、以下のようなものをすぐに提示できるよう、ファイリングし、内容を再点検します。
◆必須文書ファイル:
◆治験審査委員会(IRB/CRB)の審査関連資料
◆治験責任医師や分担医師の履歴書
◆治験契約に関する書類
◆各種手順書 など
◆被験者さんごとの資料:
◆同意説明文書(ICF): 全被験者さんの同意が適切に得られているか。
◆原資料: 症例報告書(CRF)の元データとなる電子カルテ、看護記録、検査データ、各種画像レポート、被験者日誌など。
◆症例報告書(CRF): 原資料と相違がないか。
◆治験薬関連の資料:
◆治験薬の受け払い記録
◆温度管理記録
◆治験薬の処方箋や投与記録 など
これらを、監査官が指定した被験者さんについて、すぐに参照できるように準備しておく必要があります。
3. 「本当にそんなに細かいの?」- 具体的なチェックポイントと体験談
ご質問の「ルーペで1枚ずつ確認するような」というイメージは、決して大袈裟ではありません。それくらい、細部にわたって徹底的に確認されます。
ここでは、具体的なチェックポイントと、CRC経験者が「冷や汗をかいた」体験談をいくつかご紹介します。
体験談①:同意取得日の逆転
ある監査で、「同意取得日」が、治験薬の投与を開始するために行った「スクリーニング検査の実施日」よりも後になっている被験者さんが見つかりました。つまり、同意を得る前に治験の手順を始めてしまっていたということです。
原因は、カルテへの記載漏れと確認ミスでした。監査官からは「被験者の人権保護の観点から最も重要なプロセスです」と厳しく指摘され、頭が真っ白になりました。すぐに医師と共に経緯を説明し、是正措置報告書を作成することになりました。日付の確認という基本的なことですが、忙しい業務の中で見落としてしまった痛恨のミスです。
◆チェックポイント:
◆同意説明文書の署名、日付は被験者本人、説明した医師、CRCのものか?
◆同意取得日は、治験に関連するあらゆる手順(検査、診察など)の開始日以前になっているか?
◆使用した同意説明文書のバージョンは、その時点で最新のものか?
体験談②:カルテと症例報告書(CRF)の些細な不整合
治験では、被験者さんの血圧測定を「5分間安静後に行う」とプロトコルで決まっていました。ある被験者さんのカルテには「血圧測定実施」としか書かれておらず、「5分安静」の記載がありませんでした。
監査官から「この血圧値は、プロトコルを遵守して測定されたという客観的な証拠(ソース)がありませんね」と指摘されました。もちろん、いつも通り看護師さんが適切に測定してくれたのですが、「記録にないことは、実施していないのと同じ」と見なされてしまうのです。
普段のモニタリングでは見逃されていた点だったため、冷や汗をかきました。CRCとして、原資料となるカルテにどのような記載が必要かを、事前に看護師さんたちに具体的に周知しておくべきだったと深く反省しました。
◆チェックポイント:
◆カルテや検査データと、CRFに転記された数値や日時に1mmのズレもないか?
◆誤記の訂正は、一本線で消し、日付とサイン(または捺印)がされているか?(修正液や黒塗りは絶対にNGです)
◆プロトコルで定められた手順が実施されたことが、カルテなどの原資料から客観的に追えるか?
体験談③:治験薬の温度管理記録の1時間の空白
治験薬を保管している冷蔵庫の温度管理記録をチェックされていた時のことです。毎日記録するはずの記録シートに、1箇所だけ、担当薬剤師の押印漏れが見つかりました。
さらに、別の日の24時間連続温度ロガーのデータで、深夜に1時間だけ記録が途切れている時間帯がありました。おそらくシステムの瞬断か何かだったのですが、その間の温度が保証できない、と指摘されました。治験薬の品質保証に関わる重大な逸脱として扱われ、原因究明と再発防止策の提出を求められました。
◆チェックポイント:
◆治験薬の受け取り、保管、払い出し、返却、廃棄の一連の記録に矛盾はないか?
◆温度管理は適切に行われ、記録に欠損はないか?
4. 大変さの先にある「やりがい」
これらの体験談を読むと、ますます不安に思われるかもしれません。しかし、監査はCRCを罰するためのものではなく、治験の品質をより良くするためのプロセスです。
◆チーム医療の実感: 監査対応はCRC一人では乗り切れません。医師、看護師、薬剤師、検査技師など、多くのスタッフと協力して準備を進めます。指摘事項に対してチーム一丸となって対応し、無事に監査を終えた時の達成感と連帯感は、何物にも代えがたいものです。
◆専門性の向上: 監査官からの鋭い質問に答えるためには、GCPやプロトコルを深く理解している必要があります。監査を経験するたびに、CRCとしての知識とスキルが格段に向上します。
◆治験への貢献: 完璧な監査対応ができたということは、その治験が科学的・倫理的に正しく行われたことの証明でもあります。新しい薬を待っている患者さんに、信頼できるデータを届けるという、CRCの最も重要な役割を果たせたと実感できる瞬間です。
看護師として培われた観察力、記録の正確性、多職種とのコミュニケーション能力は、監査対応において間違いなく大きな強みとなります。今は不安に感じるかもしれませんが、その一つ一つの経験が、あなたをプロフェッショナルなCRCへと成長させてくれるはずです。
CRCの監査対応:準備から当日、事後対応まで
フェーズ 主な内容とポイント 具体的な体験談・アドバイス 準備期間 期間: 監査通知から通常1ヶ月~数ヶ月。
準備内容:
・対象治験の全資料(同意説明文書、症例報告書(CRF)、治験薬管理表、有害事象報告書など)の最終確認とファイリング。
・実施医療機関のSOPや各種手順書の整備。
・担当医師や関連部署(薬剤部、検査科など)との事前打ち合わせ。
・監査官が閲覧する部屋やIT環境の準備。「過去の監査での指摘事項リストを参考に、自分の担当症例をセルフチェックしていました。特に、同意取得の日付と診察日の整合性、治験薬の投与時間と規定のズレなど、タイムスタンプが関わる部分は重点的に確認しました。」
「先輩CRCが作成した『監査準備チェックリスト』が非常に役立ちました。何から手をつけて良いか分からない新人時代には、抜け漏れを防ぐためのお守りのような存在でしたね。」監査当日 期間: 1日~数日程度。
内容:
・監査官からの質問への回答、資料の提示。
・治験関連文書(特に原資料との照合)の詳細なレビュー。
・関連部署へのインタビュー。
・治験薬や検体の保管状況の確認。「まさに、虫眼鏡で見られているような感覚でした。症例報告書に記載した血圧の値が、電子カルテの看護記録と僅かに異なっていた点を指摘され、冷や汗をかきました。測定時刻の違いによるものでしたが、その理由を明確に説明する必要がありました。」
「同意説明文書の署名欄で、被験者の方のサインが少しだけ枠からはみ出していることを指摘されたことがあります。『これも逸脱ですか?』と内心思いましたが、署名が適切に行われた経緯を丁寧に説明し、納得していただけました。」
「『このメモ書きは何ですか?』と、カルテの隅にある小さな走り書きについて質問されたことがあります。自分用の備忘録でしたが、第三者が見て誤解を招く可能性があると指導され、記録の客観性の重要さを痛感しました。」指摘事項と事後対応 指摘事項の種類:
・Critical (致命的): 治験の信頼性に重大な影響を及ぼすもの。
・Major (重大): 信頼性に影響を及ぼす可能性があるもの。
・Minor (軽微): 手順の不備など改善が望まれるもの。
事後対応:
・監査報告書を受領後、指摘事項に対する是正・予防措置(CAPA)計画書を作成し、提出する。
・計画に基づき、業務改善を行う。「有害事象の評価が、医師のカルテ記載と症例報告書で微妙に異なっていた点を『Major』で指摘されました。すぐに医師と再協議し、評価を統一して報告書を修正。再発防止策として、有害事象発生時の情報共有フローを見直すCAPAを提出し、チーム全体の意識改善に繋がりました。」
「監査は、決してCRC個人を責める場ではありません。むしろ、治験のプロセスをより良くするための共同作業です。指摘された際は、真摯に受け止め、改善策をチームで考えることで、より質の高い治験を実施できると実感しました。」
※CRC転職に特化したAIアシスタントを利用したい方はこちらから









 年収査定はこちら
年収査定はこちら
 合格予想はこちら
合格予想はこちら
 掲示板で質問をする
掲示板で質問をする







 CRC
CRC

 CRCの
CRCの
 CRCの
CRCの
 CRCの
CRCの
 CRCの
CRCの
 CRCに
CRCに
 CRCの
CRCの
 SMO
SMO
 SMO
SMO
 応募先の
応募先の
 治験
治験
 院内CRCと
院内CRCと



 2026年4月からの転職
2026年4月からの転職 CRC未経験特集
CRC未経験特集 CRC経験者特集
CRC経験者特集 看護師特集
看護師特集 臨床検査技師特集
臨床検査技師特集 保健師特集
保健師特集 薬剤師特集
薬剤師特集 管理栄養士特集
管理栄養士特集 臨床工学技士特集
臨床工学技士特集 理学療法士特集
理学療法士特集 作業療法士特集
作業療法士特集 臨床心理士特集
臨床心理士特集 MR特集
MR特集 CRA経験者特集
CRA経験者特集


 求人検索
求人検索  ログイン
ログイン 会員さま専用
会員さま専用 CRCの仕事
CRCの仕事  治験業界の研究
治験業界の研究 経験・資格別の注意点
経験・資格別の注意点 応募書類の作成
応募書類の作成 面接・適性検査の対策
面接・適性検査の対策 みんなのクチコミ
みんなのクチコミ みんなの質問と回答
みんなの質問と回答 転職成功事例
転職成功事例 マンガで分かるCRC
マンガで分かるCRC CRCばんくチャンネル
CRCばんくチャンネル 便利な機能
便利な機能 相談/年収査定/合格予想
相談/年収査定/合格予想 2026年から働くには?
2026年から働くには? 退職手続き
退職手続き 開催中のキャンペーン
開催中のキャンペーン 《CRCばんく》とは
《CRCばんく》とは